Nanostruttura biomimetica: la natura come modello
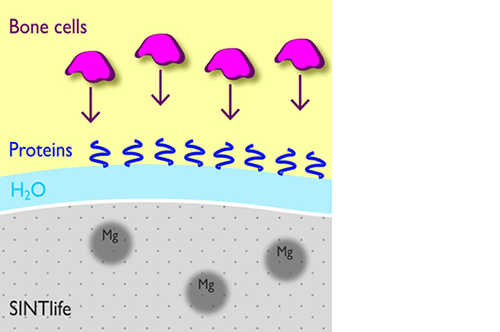
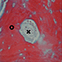
È stato dimostrato che la presenza di ioni Mg2+ deforma la struttura della cella cristallina di idrossiapatite rendendola instabile e biologicamente attiva, favorendo così la formazione ossea, il rimodellamento e un rapido riassorbimento cellulomediato del materiale.
Inoltre, la presenza di magnesio modifica le proprietà chimico-fisiche superficiali dell’idrossiapatite: il biomateriale interagisce attivamente con le molecole d’acqua* per catturare rapidamente le proteine chiave coinvolte nell’osteogenesi.
*Bertinetti et al. Langmuir (2009)
Un processo sincronizzato
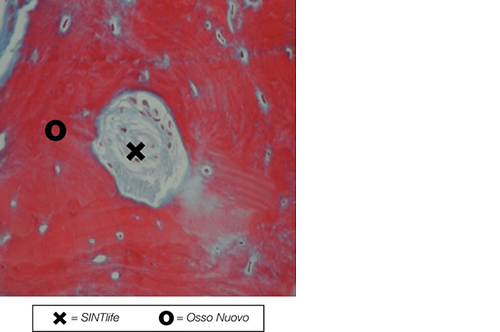
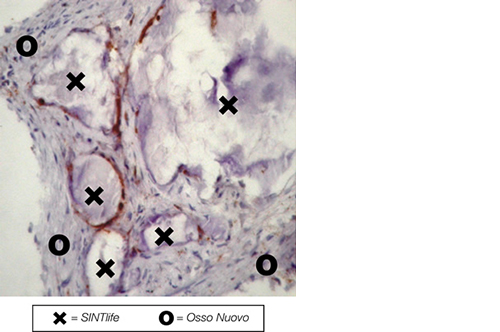
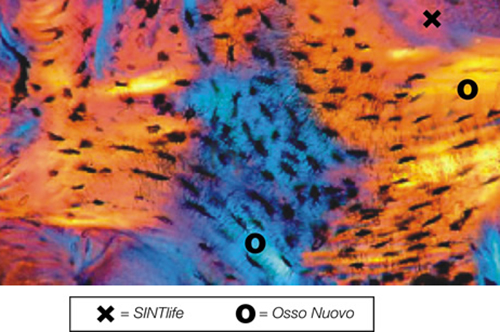
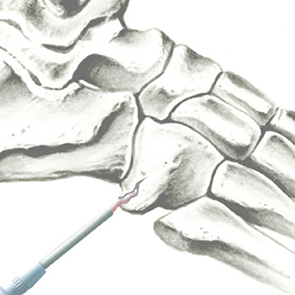
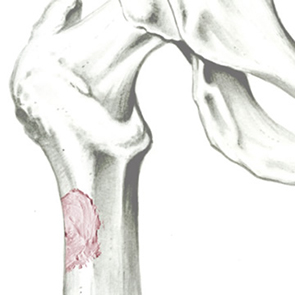
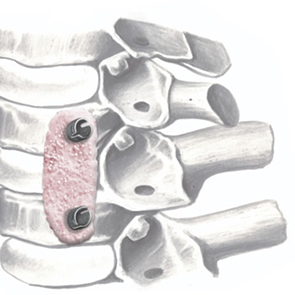
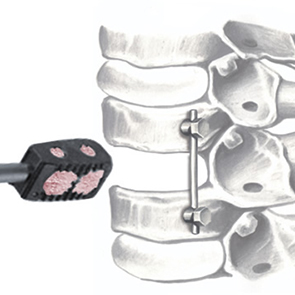
SINTlife è un materiale unico ed innovativo in grado di interagire con le cellule che prendono parte al processo di generazione di nuovo tessuto osseo. Grazie al biomimetismo chimico e geometrico nanostrutturale ed alle proprietà di superficie, SINTlife viene rimodellato e riassorbito dall’azione cellulare in un tempo fisiologicamente adeguato (6-18 mesi).
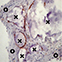
Permane nel sito di applicazione per la durata necessaria alla crescita e alla maturazione del nuovo osso. Durante la fase di rimodellamento, si può osservare l’attività di riassorbimento ad opera degli osteoclasti intorno alle particelle di SINTlife, fino ad una completa rigenerazione ossea. SINTlife promuove una ricostruzione ossea fisiologica, rapida ed efficace.
*Landi et al., J. Mater Sci: Mater Med (2008)